Insulintherapie bei Typ-2-Diabetes
Werden bei Patienten mit Diabetes mellitus Typ 2 die individuellen Zielwerte mit oralen Antidiabetika und/oder GLP-1-Rezeptoragonisten nicht erreicht, ist eine Insulintherapie erforderlich. Entsprechend den Empfehlungen der ADA (American Diabetes Association) wird zusätzlich zu Metformin oder den anderen Antidiabetika ein Basalinsulin gegeben.Natürliche Insulinausschüttung als Vorbild
Grundsätzlich gilt als Ziel der Therapie – auch beim Typ-2-Diabetes – die bestmögliche Anpassung an die physiologische Situation des Organismus. Das heißt, die Therapie, ob mit oralen Antidiabetika, GLP-1-Agonisten bzw. dualen GLP-1/GIP-Agonisten (Inkretinmimetika), Insulin oder auch die Kombination der verschiedenen Medikamente soll im idealen Fall zu einem Insulinspiegel führen, welcher der natürlichen Ausschüttung des Insulins bei einem Menschen ohne Diabetes entspricht (Abb. DT2 2, siehe auch „Was ist Diabetes“).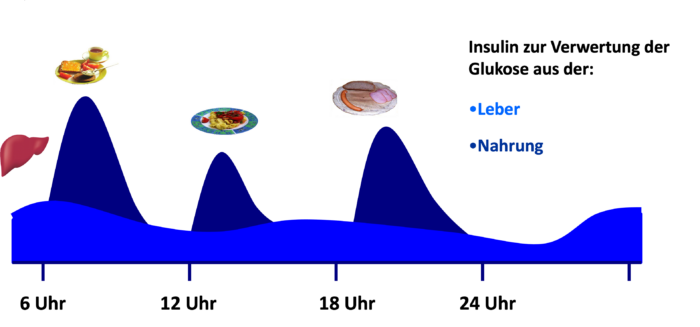 Abb. DT2 2: Natürliche Ausschüttung des Insulins bei einem Menschen ohne Diabetes (dunkles Blau: nahrungsabhängiges Insulin zur Kompensation der Kohlenhydrate aus der Nahrung, helleres Blau: nahrungsunabhängiges Insulin zur Kompensation der aus der Glykogenolyse stammenden Glukose).
Abb. DT2 2: Natürliche Ausschüttung des Insulins bei einem Menschen ohne Diabetes (dunkles Blau: nahrungsabhängiges Insulin zur Kompensation der Kohlenhydrate aus der Nahrung, helleres Blau: nahrungsunabhängiges Insulin zur Kompensation der aus der Glykogenolyse stammenden Glukose).Wann ist bei Typ-2-Diabetes eine Insulintherapie erforderlich
Die Insulintherapie ist angezeigt, wenn sich der Mensch mit Typ-2-Diabetes bereits im Stadium einer verminderten Insulinsekretion befindet. In dieser Situation ist zwar noch körpereigenes Insulin vorhanden, allerdings nicht mehr in ausreichendem Maße, um den physiologischen Insulinspiegel zu erreichen (Abb. DT2 3). Hinzu kommt noch, dass das Insulin aufgrund einer vorhandenen Insulinresistenz ungenügend wirkt.Der therapeutische Grundsatz zur Erreichung eines möglichst den natürlichen Bedingungen des Organismus entsprechenden Glukosespiegels heißt folglich: durch alle zur Verfügung stehenden Ansätze (Ernährung, Bewegung, nicht-insulinotrope Antidiabetika) soll die Insulinresistenz minimiert und gemeinsam mit der Applikation von Insulin ein physiologischer Insulinspiegel realisiert werden. Aus letzterem ergeben sich die verschiedenen Ansätze der Insulintherapie.
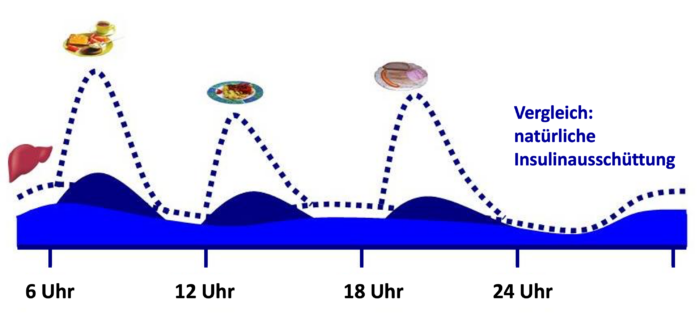 Abb. DT2 3: Verminderte Ausschüttung des körpereigenen Insulins im Stadium verminderter Insulinsekretion. Um die physiologischen Insulinspiegel zu erreichen muss Insulin zugeführt werden.
Abb. DT2 3: Verminderte Ausschüttung des körpereigenen Insulins im Stadium verminderter Insulinsekretion. Um die physiologischen Insulinspiegel zu erreichen muss Insulin zugeführt werden.Die BOT bei Typ-2-Diabetes (basal unterstützte orale Therapie)
Bei der basal unterstützen oralen Therapie (BOT) wird – zusätzlich zu den Tabletten/GLP-1-Rezeptoragonisten zur Diabetesbehandlung – einmal am Tag ein lang wirksames Insulin gespritzt. In Ausnahmefällen wird man auch eine Therapie mit GLP-1 Analoga in Kombination mit Insulin erwägen. Im Prinzip erhöht das lang wirksame Insulin den basalen, nahrungsunabhängigen Insulinspiegel. Vor allem wird dafür gesorgt, dass erhöhte Nüchternglukosewerte gesenkt werden, falls diese trotz bestehender Therapie mit oralen Antidiabetika/Inkretinmimetika noch vorliegen. Das den basalen Insulinbedarf abdeckende Insulin unterstützt zusammen mit den nicht-insulinären Antidiabetika die Wirkung des körpereigenen Insulins zu den Mahlzeiten (Abb. DT2 4). Notwendig ist bei der BOT die Kontrolle des Glukosespiegels, entweder durch die Blutzuckerselbstkontrolle oder die kontinuierliche Glukosemessung (CGM).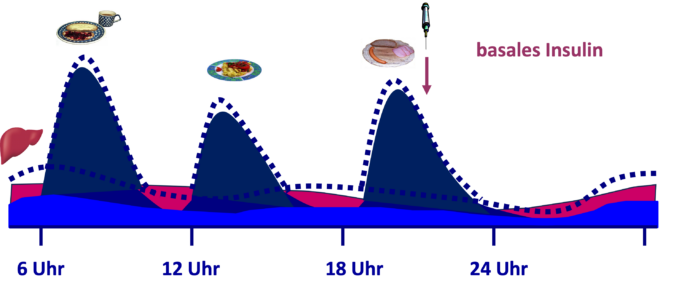 Abb. DT2 4: Unter der BOT sorgt das zusätzlich zu den nicht-insulinären Antidiabetika zugeführte basale Verzögerungsinsulin für die Anhebung des basalen Insulinspiegels. Gemeinsam mit den nicht-insulinären Antidiabetika unterstützt dies die Wirkung des körpereigenen Insulins zu den Mahlzeiten (gestrichelte Kurven: natürliche Insulinausschüttung, pink: basales Insulin, helleres Blau: nahrungsunabhängiges Insulin zur Kompensation der aus der Glykogenolyse stammenden Glukose, dunkles Blau: nahrungsabhängiges Insulin zur Kompensation der Kohlenhydrate aus der Nahrung).
Abb. DT2 4: Unter der BOT sorgt das zusätzlich zu den nicht-insulinären Antidiabetika zugeführte basale Verzögerungsinsulin für die Anhebung des basalen Insulinspiegels. Gemeinsam mit den nicht-insulinären Antidiabetika unterstützt dies die Wirkung des körpereigenen Insulins zu den Mahlzeiten (gestrichelte Kurven: natürliche Insulinausschüttung, pink: basales Insulin, helleres Blau: nahrungsunabhängiges Insulin zur Kompensation der aus der Glykogenolyse stammenden Glukose, dunkles Blau: nahrungsabhängiges Insulin zur Kompensation der Kohlenhydrate aus der Nahrung).Die Leitlinien empfehlen, mit 10 E/Tag oder 0,1-0,2 E/kg/Tag eines Verzögerungsinsulins oder lang wirksamen Insulinanalogons zu beginnen. Die Dosis soll zweimal in der Woche um 10-15% oder 2 bis 4 Einheiten (E) erhöht werden, bis das Nüchternblutzuckerziel erreicht ist. Das Nüchternblutzuckerziel muss individuell festgelegt werden und hängt von Alter und Begleiterkrankungen ab. Tritt eine Unterzuckerung auf, soll zunächst versucht werden, die Ursache herauszufinden und möglichst abzustellen. Findet sich kein plausibler Grund sollte die Dosis des Basalinsulins um 4 Einheiten oder 10-20% wieder gesenkt werden.
Ergänzung der basal unterstützten oralen Therapie (BOT)
Wird mit einer BOT das Therapieziel nicht erreicht, ist der nächste Schritt entsprechend den Leitlinien: Hinzufügen eines schnell wirksamem Insulins zur Hauptmahlzeit.Dazu wird die BOT fortgeführt, ergänzend werden zur Hauptmahlzeit 4 Einheiten (E) oder 0,1 E/kg oder 10% der basalen Dosis vor der Hauptmahlzeit verabreicht. Sollte der HbA1c-Wert kleiner 8% sein, muss erwogen werden, die Dosis des Basalinsulins zu reduzieren.
Zweimal in der Woche wird die Dosis um 1 bis 2 Einheiten oder 10-15% erhöht, bis das individuelle Blutzuckertagesprofil erreicht ist.
Sollten Unterzuckerungen auftreten, muss versucht werden die Ursache herauszufinden. Eventuell muss die Dosis um 2-4 Einheiten oder 10-20% reduziert werden.
Sollten sich mit diesen Maßnahmen das individuelle Einstellungsziel nicht erreichen lassen, wird eine Basis-Bolustherapie (BBT) erwogen.
Die Supplementäre Insulintherapie (SIT) bei Typ-2-Diabetes
Eine weitere Version der nicht-intensivierten Insulintherapie ist die Supplementäre Insulintherapie (SIT). Dabei werden orale Antidiabetika /Inkretinmimetika mit kurz wirksamen Insulinen bzw. Analoginsulinen kombiniert. Letztere werden zu den Hauptmahlzeiten injiziert, damit die postprandialen Glukoseanstiege kontrolliert werden. Das macht die Kontrolle des Glukosespiegels notwendig, um die Insulindosis zu den Mahlzeiten anzupassen (falls keine feste Ernährungsschemata und Spritzpläne verwendet werden). Angewendet wird diese Form der Insulintherapie bei Menschen mit Typ-2-Diabetes, welche aufgrund nachlassender körpereigener Insulinproduktion die postprandialen Glukoseanstiege nicht mehr im Zielbereich halten können.Sowohl die SIT als auch die BOT stellen Varianten der nicht-intensivierten Insulintherapie dar, die bei weiterer Abnahme der körpereigenen Insulinproduktion durch die Zugabe weiterer Insulindosierungen zur intensivierten konventionelle Insulintherapie (ICT) ausgebaut werden können (Abb. DT2 5).
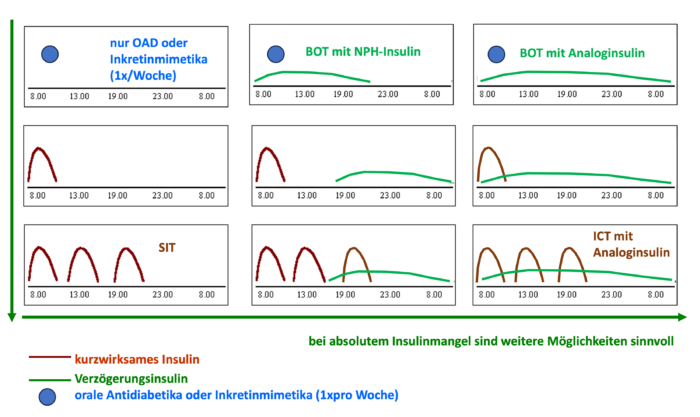 Abb. DT2 5: Varianten der Therapie bei Menschen mit Typ-2-Diabetes von oralen Antidiabetika und/oder Inkretinmimetika bis zur BOT und von der SIT und der BOT bis zur ICT. (BOT – basal unterstützte orale Therapie, SIT – Supplementäre Insulintherapie, ICT – intensivierte konventionelle Insulintherapie). Die Wirkprofile der verschiedenen langwirksamen Insuline (Analoginsuline, auch NPH-Insulin) lassen eine individuelle Anpassung innerhalb der Therapieoptionen zu.
Abb. DT2 5: Varianten der Therapie bei Menschen mit Typ-2-Diabetes von oralen Antidiabetika und/oder Inkretinmimetika bis zur BOT und von der SIT und der BOT bis zur ICT. (BOT – basal unterstützte orale Therapie, SIT – Supplementäre Insulintherapie, ICT – intensivierte konventionelle Insulintherapie). Die Wirkprofile der verschiedenen langwirksamen Insuline (Analoginsuline, auch NPH-Insulin) lassen eine individuelle Anpassung innerhalb der Therapieoptionen zu.Die Konventionelle Insulintherapie (CT) bei Typ-2-Diabetes
Diese Therapieform wird nur noch in Ausnahmefällen bei wenigen Patienten (mit Typ 1 und Typ 2 Diabetes) durchgeführt. Sie kommt überwiegend für ältere Menschen mit einem regelmäßigen Tagesablauf in Frage, bzw. ist für Patienten gedacht, für die eine möglichst einfache Insulintherapie erforderlich ist. Die Gabe von festgelegten Insulindosen setzt ein festes Ernährungsschema voraus, um das Verhältnis Insulin, das den Blutzucker senkt, und zugeführter Kohlenhydrate (BE, KE), die den Blutzucker erhöhen, im Gleichgewicht zu halten.Das Risiko von Unterzuckerungen ist im Vergleich zur bedarfsangepassten, intensivierten Insulintherapie (ICT) bei der CT deutlich erhöht. Außerdem schränken feste Ernährungsschemata und Spritzpläne die Flexibilität im Alltag ein, was für noch sehr aktive Menschen ein wesentlicher Nachteil ist. Wird mit einer konventionellen Insulintherapie (CT) das individuelle Therapieziel nicht erreicht, sollte eine intensivierte Insulintherapie (ICT) erwogen werden.
Das Prinzip der konventionellen Insulintherapie (CT)
Lang wirksames oder intermediär wirksames Insulin oder Mischungen aus intermediär und schnell wirksamem Insulin werden in einem festen Mischverhältnis ein- bis zweimal täglich, in seltenen Ausnahmefällen bis zu dreimal täglich injiziert.Die Dosis des basalen Insulins wird aufgeteilt auf 2/3 morgens und 1/3 abends oder ½ morgens und 1/2 abends. Das Basalinsulin wird durch ein Kombinationsinsulin ersetzt.
Zweimal in der Woche wird die Dosis um 1 bis 2 Einheiten erhöht, bis das individuelle Einstellungsziel erreicht ist. Bei einer Unterzuckerung sollte versucht werden, die Ursache herauszufinden. Eventuell muss die Dosis des Insulins um 2-4 Einheiten oder 10-20% reduziert werden.
Blutzucker-Selbstkontrolle bei der CT ist wichtig
Auf jeden Fall müssen Patienten mit einer Konventionellen Insulintherapie (CT) ihren Blutzucker selbst messen. In regelmäßigen Abständen sollten sie Blutzuckertagesprofile erstellen. In der Regel reicht ein Tagesprofil einmal pro Woche aus. Die Werte müssen dokumentiert und zum nächsten Arztgespräch mitgenommen werden.Zunehmend wird diskutiert, auch unter nicht-intensivierten Formen der Insulintherapie die kontinuierliche Glukosemessung (CGM) einzusetzen, ggf. auch durch Selbstzahlung durch die Betroffenen.
Zwischenmahlzeiten sind bei der CT nicht immer notwendig Der Nachteil der konventionellen Insulintherapie ist das festgelegte Wirkungsprofil des injizierten Insulins. Die Dosis wird nicht angepasst und das Verhältnis von schnell wirksamem zu langsam wirksamem Insulin ist fest vorgegeben (in der Regel durch die Zusammensetzung der angewendeten Mischinsuline). Die betroffenen Patienten müssen sich deshalb in ihrem Tagesablauf in Menge und Zeitpunkt ihrer Mahlzeiten an einen festen Ablauf halten. Das ist ein wesentlicher Nachteil für Menschen mit Typ-2-Diabetes, die noch im Arbeitsalltag stehen und/oder auch eine flexible Gestaltung ihres Lebens bevorzugen (Abb. T2D 6).
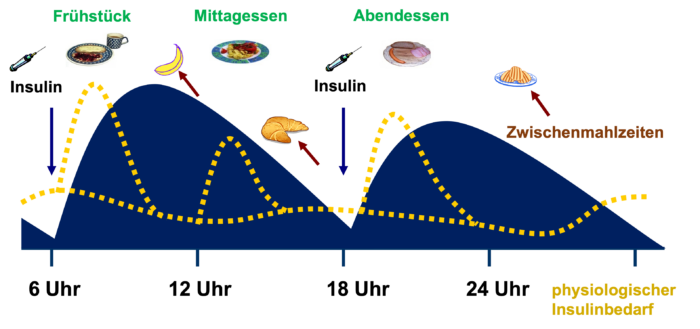 Abb. T1D 6: Insulinspiegel unter der konventionellen Insulintherapie (CT) bei zweimaligem Spritzen mit Mischinsulin. Es muss gegen das gespritzte Insulin angegessen werden, wozu die Essenszeiten eingehalten und u.a. Zwischenmahlzeiten notwendig sind (gelb gestrichelt zum Vergleich: Insulinausschüttung bei einem Menschen ohne Diabetes). Wird auf Zwischenmahlzeiten verzichtet, so bilden die hohen Insulinüberhänge eine Gefahr für Unterzuckerungen.
Abb. T1D 6: Insulinspiegel unter der konventionellen Insulintherapie (CT) bei zweimaligem Spritzen mit Mischinsulin. Es muss gegen das gespritzte Insulin angegessen werden, wozu die Essenszeiten eingehalten und u.a. Zwischenmahlzeiten notwendig sind (gelb gestrichelt zum Vergleich: Insulinausschüttung bei einem Menschen ohne Diabetes). Wird auf Zwischenmahlzeiten verzichtet, so bilden die hohen Insulinüberhänge eine Gefahr für Unterzuckerungen.Insuline für die konventionelle Insulintherapie (CT)
Es gibt Mischungen mit schnell wirksamen Insulinanaloga (NovoMix®/Humalog Mix®). Dieses schnell wirksame Insulinanalogon hat eine Wirkdauer von ungefähr 2-3 Stunden und ein Wirkmaximum nach ungefähr einer Stunde.Die Insuline werden in der Regel zu den Hauptmahlzeiten verabreicht. Bei Mischungen mit schnellen Insulinanaloga sind Zwischenmahlzeiten nicht erforderlich.
Normales, humanes Insulin hat je nach Dosis eine Wirkdauer zwischen 4 und 6 Stunden und ein Wirkmaximum bei ungefähr 2 Stunden. Nach 2 Stunden ist der überwiegende Teil der Kohlenhydrate bereits im Körper aufgenommen und abgebaut. Die Insulinspiegel sind jedoch noch hoch. Zur Vermeidung von Unterzuckerungen müssen daher Kohlenhydrate zugeführt werden. Daher ist bei Mischungen mit normalem, humanem Insulin die Einnahme regelmäßiger Zwischenmahlzeiten wegen der hohen Insulinspiegel zwischen den Mahlzeiten meist erforderlich. Dies fördert dann die Gewichtszunahme.
Die obigen Empfehlungen zu Insulintherapie sind modifiziert nach den Leitlinien der ADA:
Standards of Medical Care in Diabetes – 2024, Diabetes Care Volume 47, Supplement 1, January 2024, 9. Pharmacologic Approaches to Glycemic Treatment. S158–S178
BBT (Basis Bolus Therapie) bzw. ICT bei Typ-2-Diabetes
Bei einer Basis Bolus Therapie (BBT) spritzen die Patienten ein lang wirksames Insulin, um den Grundbedarf abzudecken. Zu den Mahlzeiten wird zusätzlich ein schnell wirksames Insulin gespritzt. Der Blutzucker muss selbst gemessen werden. Prinzipiell handelt es sich bei der BBT also um die intensivierte konventionelle Insulintherapie (ICT).Auch bei Menschen mit Typ-2-Diabetes bietet die BBT bzw. ICT mehrere Vorteile, weil sie sich an den natürlichen Verhältnissen des Organismus orientiert. Die Folge sind eine im Vergleich zur konventionellen Insulintherapie (CT) meist wesentlich bessere Einstellung des Blutzuckers, was das Risiko für die Entwicklung diabetischer Folgekrankheiten deutlich reduziert. In Bezug auf den Lebensstil ist eine erheblich größere Flexibilität bei der Ernährung und Gestaltung des Tagesablaufes möglich. Für diese Patienten ist die Selbstkontrolle des Glukosespiegels essentiell, was mit moderner Diabetestechnologie wie der kontinuierlichen Glukosemessung lückenlos und zeitnah möglich ist. Prinzipiell bedarf die Anwendung der BBT / ICT der vorherigen strukturierten Schulung.
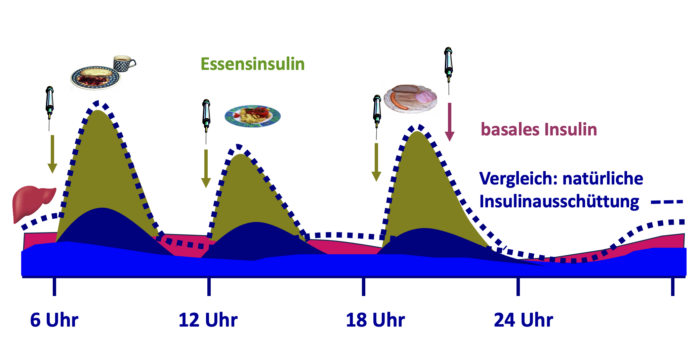 Abb. T2D 7: Wirkungsprofil des Insulins unter der intensivierten konventionellen Insulintherapie (ICT) bei Menschen mit Typ-2-Diabetes. Bei dieser Therapieform wird kurzwirksames Insulin zu den Mahlzeiten injiziert (grün), um das nicht ausreichend vorhandene körpereigene Insulin (dunkelblau) zu ergänzen. Der ebenfalls nicht ausreichend vorhandene basale Insulinspiegel (helleres blau) wird durch Verzögerungsinsulin ergänzt (pink).
Abb. T2D 7: Wirkungsprofil des Insulins unter der intensivierten konventionellen Insulintherapie (ICT) bei Menschen mit Typ-2-Diabetes. Bei dieser Therapieform wird kurzwirksames Insulin zu den Mahlzeiten injiziert (grün), um das nicht ausreichend vorhandene körpereigene Insulin (dunkelblau) zu ergänzen. Der ebenfalls nicht ausreichend vorhandene basale Insulinspiegel (helleres blau) wird durch Verzögerungsinsulin ergänzt (pink).Zusätzlich zur Hauptmahlzeit wird zu den anderen Mahlzeiten ein schnell wirksames Insulin verabreicht. Begonnen wird mit 4 Einheiten (E), 0,1 E/KG oder 10% des Basalinsulins vor jeder Mahlzeit. Ist der HbA1c kleiner 8% muss eventuell die Dosis des Basalinsulins reduziert werden.
Zweimal in der Woche wird die Dosis um 1 bis 2 Einheiten oder 10-15% gesteigert, bis das individuelle Einstellungsziel erreicht ist.
Treten Unterzuckerungen auf, muss versucht werden, die Ursache zu finden. Eventuell muss die Dosis der letzten Injektion vor der Unterzuckerung um 2-4 Einheiten oder 10-20% reduziert werden.
Dabei ist darauf zu achten, dass der Patient nicht an Gewicht zunimmt. Metformin sollte – solange es vertragen wird und keine Kontraindikationen bestehen – weitergegeben werden. Die zusätzliche Kombination mit anderen oralen Antidiabetika sollte für jeden einzelnen Patienten getrennt festgelegt werden. Bei fast allen Patienten mit Diabetes mellitus Typ 2 reicht es aus, feste Insulindosen zu verabreichen. Bei den übergewichtigen Patienten ist eine Anpassung an die zugeführte Nahrung nicht erforderlich, da sie in der Regel die Einstellung nicht verbessert und das Risiko der Gewichtszunahme erhöht ist. Viel wichtiger ist eine lebenslange Ernährungsumstellung und Motivation. Damit kann viel mehr erreicht werden als mit der Anpassung der Insulindosen an die zugeführten Kohlenhydrateinheiten (KHE).
Anders als in der Vergangenheit tritt der Typ-2-Diabetes immer häufiger auch bei jüngeren Menschen auf, die noch im Arbeitsprozess stehen. Bei diesen ist schon allein wegen der Lebensführung und dem Arbeitsalltag eine ICT angezeigt. Mit der kontinuierlichen Glukosemessung (CGM) wird das Therapiemanagement erheblich erleichtert, weshalb dessen Anwendung bei intensiviert mit Insulin behandelten Menschen, also auch bei dieser Klientel von den Kostenträgern erstattet wird [1].
Ist eine Insulinpumpentherapie bei Typ-2-Diabetes sinnvoll?
Der Einsatz von Insulinpumpen bei Menschen mit Typ-2-Diabetes für die manuelle Durchführung, also die CSII, und auch im Rahmen der halbautomatisierten hybriden Insulinabgabe mit AID-Systemen (AID – Automated Insulin Delivery) wird kontrovers diskutiert. Fakt ist, dass es für die Therapie mit Insulinpumpen in Deutschland keine Kostenerstattung gibt, von gut begründeten Ausnahmen einmal abgesehen [2].Bei Menschen mit Typ-1-Diabetes fehlt in der Regel vollständig das körpereigene Insulin. Der Einsatz von Insulinpumpen soll den natürlichen Insulinbedarf dieser Menschen näherungsweise nachahmen. Der Schatz der Insulinpumpentherapie (egal ob manuell oder durch ein CGM gesteuert) ist aktuell noch die basale Insulinabgabe.
Bei den derzeitigen AID-Systemen handelt es sich um Hybrid-Systeme, d.h. die basale Insulinabgabe erfolgt automatisch, die Boli zu den Mahlzeiten müssen nach wie vor manuell abgegeben werden. Durch die individuell angepasste basale Insulinabgabe wird bei Menschen mit Typ-1-Diabetes die zirkadiane Rhythmik nahezu exakt nachvollzogen. Bei Menschen mit Typ-2-Diabetes ist dies jedoch gar nicht notwendig, denn bei diesen ist in der Regel körpereigenes Insulin vorhanden, nur eben nicht mehr in ausreichendem Maße (siehe oberstehende Abb. DT2 2).
Das körpereigene Insulin wird bei Menschen mit Typ-2-Diabetes auf natürliche Weise zirkadian ausgeschüttet, wodurch eine subtil gesteuerte basale Insulindosierung nicht nötig erscheint. Prinzipiell würde eine preiswerte Insulinpumpe mit der Abgabe einer konstanten Basalrate genügen, welche den gesamten basalen Insulinspiegel anhebt [Abb. DT2 8). Ein System, wie es Menschen mit Typ-1-Diabetes nutzen, ist bei Menschen mit Typ-2-Diabetes nicht notwendig – weder für die manuelle, noch die automatische Insulinabgabe.
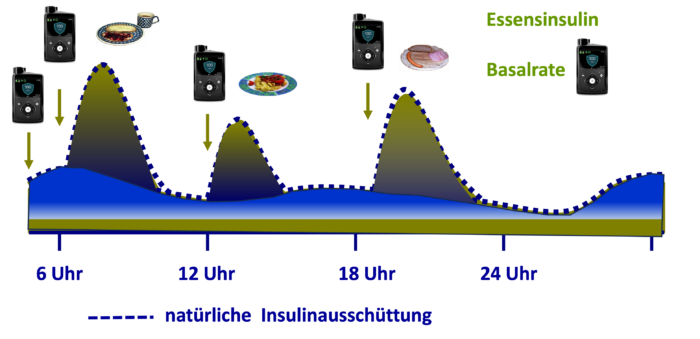 Abb. DT2 8: Insulinspiegel bei Menschen mit Typ-2-Diabetes mit physiologischem Insulindefizit. Durch die Insulinpumpe wird das fehlende Insulin zugeführt, als konstante Basalrate (grün), welche den physiologischen (Rest)insulinspiegel anhebt und bei den Bolusgaben die nicht ausreichende postprandiale Glykämie (dunkelblau) ergänzt (grün).
Abb. DT2 8: Insulinspiegel bei Menschen mit Typ-2-Diabetes mit physiologischem Insulindefizit. Durch die Insulinpumpe wird das fehlende Insulin zugeführt, als konstante Basalrate (grün), welche den physiologischen (Rest)insulinspiegel anhebt und bei den Bolusgaben die nicht ausreichende postprandiale Glykämie (dunkelblau) ergänzt (grün).Ist ein AID-System bei Typ-2-Diabetes sinnvoll?
Wenn dagegen einmal vollautomatische Systeme zur Automatischen Insulinabgabe (AID-Systeme) verfügbar sein werden, dann betrifft die automatische Regelung auch die Gabe der Mahlzeitenboli. Dies würde zu einer zuverlässigen postprandialen Glykämie führen und damit ein neues Argument für die Anwendung von AID-Systemen auch bei Typ-2-Diabetes bieten.Gegenwärtig würde der Einsatz der aktuellen Hybrid-AID-Systeme bei Menschen mit Typ-2-Diabetes die gleichen Indikationen betreffen, die auch den seltenen Einsatz der klassischen Insulinpumpentherapie rechtfertigen [3]:
- eine schwere, ausgeprägte Insulinresistenz, verbunden mit hohem Insulinverbrauch, die durch die pulsatile Abgabe von ausschließlich kurzwirksamem Insulin überwunden werden kann,
- jüngere Typ-2-Diabetiker, welche absolut keine gute glykämische Einstellung erreichen (Ultima Ratio),
- häufige, schwere, unbemerkte nächtliche Hypoglykämien,
- ausgeprägte diabetische Folgeerkrankungen (z.B. schmerzhafte Neuropathie).
Fazit; Insulinpumpen, angewendet als klassische CSII oder auch automatisiert als AID, sind eine Domäne für die Behandlung des Typ-1-Diabetes. Für Menschen mit Typ-2-Diabetes bleiben sie eine Ausnahme unter dem Aspekt strenger Indikationen. Positive Ergebnisse von AID-Systemen können darüber nicht hinwegtäuschen (z.B. [4]).
Eine Übersicht der aktuellen Insuline sehen Sie hier auf diabetes-news.
Literatur:
[1] Bundesministerium für Gesundheit: Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden vertragsärztliche Versorgung: Kontinuierliche interstitielle Glukosemessung mit Real-Time-Messgeräten (rtCGM) zur Therapiesteuerung bei Patientinnen und Patienten mit insulinpflichtigem Diabetes mellitus vom 16. Juni 2016. Bundesanzeiger, herausgegeben vom Bundesministerium der Justiz und für Verbraucherschutz, vom 6. September 2016. https://www.g-ba.de/downloads/39-261-2623/2016-06-16_MVV-RL_rtCGM_BAnz.pdf?msclkid=ddce3b8ad03111ec9258e12d62f0496e. Letzter Zugriff: 12.06.2025.
[2] Sozialmedizinische Stellungnahme zur Behandlung des Diabetes mellitus mit externen Insulinpumpen; April 2006, S. 7f; erstellt durch die Sozialmedizinische Expertengruppe „Versorgungsstrukturen“ (SEG-3) der MDK-Gemeinschaft
[3] Henrichs HR, Liebl A, Reichel A, Quester W, Freckmann G, Fach E-M, Thomas A für die AGDT der DDG. Experimentelle Untersuchungen und klinische Evidenz der Insulinpumpentherapie (CSII). Diabetologie und Stoffwechsel 2009; 4: 390–397
[4] Pasquel FJ, Davis GM, Huffman DM, Peters AL, Parker JC, Laffel LM, Romeo GR, Mathew J, Castorino KN, Kruger DF, Dungan KM, Kipnes M, Jauch EC, Oser TK, Shah VN, Horowitz B, Carlson AL, Warren ML, Deeb W, Buse JB, Reed JH, Berner J, Blevins T, Bajaj C, Kollman C, Raghinaru D, Ly TT, Beck RW; Omnipod 5 SECURE-T2D Consortium. Automated Insulin Delivery in Adults With Type 2 Diabetes: A Nonrandomized Clinical Trial. JAMA Netw Open. 2025 Feb 3;8(2):e2459348
Kategorisiert in: Therapie Typ 2
Dieser Artikel wurde verfasst von admin










