Technische Optionen der Insulinpumpentherapie
Auch wenn es sicher eine Frage der Definition ist, man muss den Begriff „Insulinpumpentherapie“ durch eine Reihe von Innovationen erweitern.Ab dem Jahr 2007 wurde die Anbindung eines Systems zur kontinuierlichen Glukosemessung (CGM-System) an Insulinpumpen mit dem Ziel realisiert, die „klassische“ Insulinpumpentherapie schrittweise zu automatisieren, wodurch verschiedene Varianten der Insulinpumpentherapie entstanden sind:
- Klassische Insulinpumpentherapie (CSII), also die manuelle Steuerung der Insulinpumpe durch den Anwender, wobei die Basalrate nach vorheriger Festlegung und Programmierung zeit- bzw. dosisgesteuert abgegeben wird.
- Sensorunterstützte Pumpentherapie (SuP = CSII + CGM): Anbindung eines CGM-Glukosesensors an die Insulinpumpe, wodurch sich verschiedene Optionen ergeben: – SuP ohne Beeinflussung der Insulinabgabe. Die CGM-Daten werden auf dem Display der Insulinpumpe nur dargestellt, inklusive der Alarmfunktionen. Dazuzuzählen ist jede Nutzung einer Insulinpumpe mit gleichzeitiger Nutzung eines CGM, auch wenn beide technisch nicht gekoppelt sind, der Anwender aber die CGM-Daten für sein Therapiemanagement nutzt.
- Automatisierte Insulinabgabe (AID – System: Automated Insulin Delivery).
– SuP mit automatischer Abschaltung der Insulinzufuhr im Fall einer Hypoglykämie (auch bezeichnet als LGS – Low Glucose Suspend).
– SuP mit vorausschauender automatischer Abschaltung der Insulinzufuhr bei Gefahr einer Hypoglykämie und der automatischen Wiederzuschaltung, wenn die Gefahr einer Hypoglykämie gebannt ist (auch bezeichnet als PLGM – Predictive Low Glucose Management bzw. PLGS – Predictive Low Glucose Suspend)
Die Sensorunterstützte Pumpentherapie (SuP)
Die SuP stellt einen Zwischenschritt von der „klassischen“ CSII zur CSII mit AID dar, realisiert sie damit hardwaremäßig die Verbindung einer Insulinpumpe und eines CGM zu einem System. Der wesentliche Aspekt der SuP liegt dabei auf der Vermeidung von Hypoglykämien durch Unterbrechung der Insulinabgabe der Insulinpumpe: Entweder bei Erreichung des eingestellten Hypoglykämie-Schwellwertes (i.d.R. wurden 70 mg/dl (3,9 mmol/l)) oder vorausschauend, wenn sich anhand der CGM-Werte zeigte, dass sich die Werte in Richtung der Hypoglykämie-Schwelle bewegten.Vermeidung vom Hypoglykämien durch die Sensorunterstützte Pumpentherapie
Bei der Variante der Unterbrechung der Insulinabgabe bei Erreichung des Hypoglykämie-Schwellwertes erfolgt zunächst ein Alarm. Reagierte der Patient nicht darauf, so wird die Insulinabgabe automatisch für eine gewisse Zeit (z.B. 120 min) unterbrochen. Nach Ablauf dieser Zeit schaltet sie sich wieder zu, falls dies der Patient nicht vorher manuell getan hat (LGS – Low Glucose Suspend). Mitunter treten dabei trotzdem milde Hypoglykämien auf, z.B. wenn der Schwellwert auf oder unterhalb des Niveaus der Hypoglykämie eingestellt wird. Bei der prädiktiven Unterbrechung der Insulinabgabe besteht der Vorteil, dass zu diesem Zeitpunkt noch keine Hypoglykämie vorliegt, nun aber verhindert werden kann. Die Abschaltung erfolgt automatisch, ebenso nachfolgend die selbständige Wiederaufnahme der Insulinabgabe, wenn die Gefahr der Hypoglykämie vorbei ist (Abb. T1D8). Der Patient selbst muss davon gar nichts bemerken, wenn er die Warnmeldungen ausgeschaltet hat.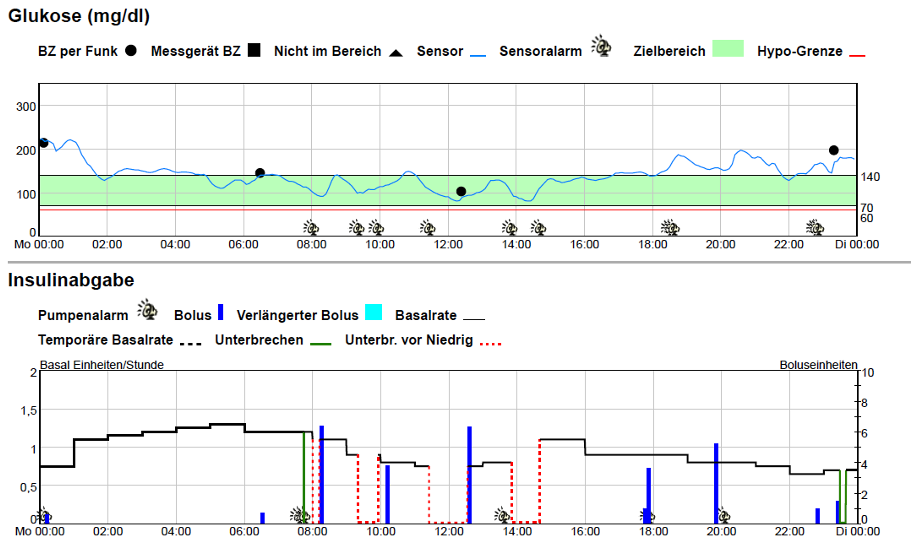 Abb. T1D8: Wirkung der prädiktiven Hypoglykämieabschaltung bei einem Menschen mit Typ-1-Diabetes. Die Abschaltung erfolgte immer rechtzeitig bei sinkenden Glukosewerten (oben anhand des Glukoseprofils, daraus resultieren die unten gezeigten rot-gestrichelten Bereiche in der Insulinabgabekurve). Das sorgt für einen stabilen Glukoseverlauf auf gutem Glukoseniveau ohne Hypoglykämien.
Abb. T1D8: Wirkung der prädiktiven Hypoglykämieabschaltung bei einem Menschen mit Typ-1-Diabetes. Die Abschaltung erfolgte immer rechtzeitig bei sinkenden Glukosewerten (oben anhand des Glukoseprofils, daraus resultieren die unten gezeigten rot-gestrichelten Bereiche in der Insulinabgabekurve). Das sorgt für einen stabilen Glukoseverlauf auf gutem Glukoseniveau ohne Hypoglykämien.Ergebnisse von Studien zur Sensorunterstützten Pumpentherapie
In der Datenbank Pubmed finden sich über 470 englischsprachige Artikel über klinische Ergebnisse, erzielt mit der SuP. Als Beispiel für den Erfolg der Hypoglykämieabschaltung seien die Ergebnisse einer pädiatrischen Studie mit Kindern im Altersdurchschnitt von 11,5 Jahren angeführt [1]. Der „Grenzwert Niedrig“ war auf 70 mg/dl (3,9 mmol/l) gesetzt worden. Pro Patient traten durchschnittlich etwas mehr als 3 prädiktive Unterbrechungen/Tag auf. Die tiefsten Glukosewerte während der Abschaltung lagen bei 78 mg/dl. Die Exkursionen in den Glukosebereich ≤70mg/dl waren sehr selten, schwere Hypoglykämie wurden gar keine registriert. Das zeigt die Effektivität dieser prädiktiven Abschaltung.Die Insulinpumpen, die direkt für die SuP entwickelt wurden (MiniMed VEO, MiniMed 640G, t.slim X2 Basal-IQ) sind mittlerweile durch Nachfolgemodelle für die AID-Nutzung ersetzt. Werden aber Systeme wie das AID-System MiniMed 780G im manuellen Modus genutzt, so wird daraus die SuP mit Hypoglykämieabschaltung realisiert.
Die Insulinpumpentherapie (CSII) erweitert zum automatisierten System (AID)
Systeme für die automatisierte Insulingabe (AID-Systeme) gehörten seit Jahrzehnten zu den Wünschen von Menschen mit Typ-1-Diabetes. Teilweise wurde dies ab 2016 in den USA und ab 2019 auch in Deutschland realisiert. Allerdings handelt es sich auch bei den aktuellen Geräten (2025) noch nicht um vollautomatische, sondern um Hybrid-AID-Systeme.Grundprinzip der automatisierten Insulingabe (AID)
AID-Systeme zeichnen sich dadurch aus, dass sich im automatisierten Modus die basale Insulinabgabe nach den durch den Glukosesensor gemessenen Werten richtet. Es gibt einen „Setpoint“, welchen das System anstrebt. Dieser wird vor der Nutzung festgelegt, zum Beispiel 100 mg/dl (5,6 mmol/l) oder 120 mg/dl (6,7 mmol/l). Die verschiedenen verfügbaren AID-Systeme haben unterschiedlich wählbare Setpoints. Das System versucht, die Insulinabgabe entsprechend zu regulieren: mehr Insulin, wenn der Glukosespiegel ansteigt, weniger Insulin, wenn er sinkt. Als Algorithmen werden im Wesentlichen der MPC (Model Predictive Control) und bei den Systemen von Medtronic der sogenannte „PID-Algorithmus“ (Proportional-Integral-Differentialregelung) angewendet. Beide Algorithmen sind aus der Regelungstechnik gut bekannt und werden in den AID-Systemen entsprechend modifiziert.[2,3]Die Regelung erfolgt in dem zeitlichen Abstand, in dem ein CGM-Messwert vorliegt. Beispielsweise sind das bei den Systemen von Medtronic 5 Minuten. Bei diesen Systemen ist die basale Insulingabe bis zu einem konkreten Glukosewert auf „Null“ gesetzt. Mit dem Glukosewert wird ein Minibolus berechnet. Die Ermittlung der Bolusgröße kann plausibel gemacht werden mit der Berechnung eines Korrekturbolus, wie es allgemein in der Insulintherapie üblich ist. Er ergibt sich zunächst aus der Differenz von aktuellem Glukosewert und Zielwert, multipliziert mit dem Faktor der Insulinempfindlichkeit (eine Einheit Insulin senkt den Glukosewert um xx mg/dl).
Weiterhin ist noch zu beachten, wie lange das Insulin wirkt (das ergibt sich aus deren Pharmakodynamikkurve) und wie viel aktiv wirkendes Insulin noch vorhanden ist. Folglich muss dem Algorithmus bekannt sein, wie lange das Insulin wirkt – das wird in dem System eingestellt (z.B. 2-3 Stunden bei Erwachsenen) und wie die Insulinsensitivität ist. Letzteres errechnet sich zum Beispiel eine MiniMed-Pumpe aus dem Tagesinsulinbedarf, ähnlich auch der CAM APSFX-Algorithmus, der das mylife loop-System steuert.
Automatisierte Insulinabgabe:der Algorithmus berechnet die Menge
Der Algorithmus rechnet aus, wie viel Insulin zur Erreichung des Setpoint-Glukosewertes nötig ist. Dabei berücksichtigt er die Insulinwirkdauer und die dafür bekannte Wirkungskurve. Die Wirkdauer teilt er in 5-Minuten-Abschnitte, weil ja alle 5 Minuten ein Mikrobolus abgegeben wird. Ist z.B. eine Insulinwirkdauer von 3 Stunden eingestellt, so wären das 36 Mikroboli in dieser Zeit (alle 5 min). Zur Abgabe gelangt nun aber nur der erste Mikrobolus, denn 5 min später wird diese Rechnung erneut vorgenommen. Weiterhin wird die Wirkung des vorher abgegebenen Insulins berücksichtigt, so wie das z.B. bei einem Bolusrechner der Fall ist.Aus dieser Vorgehensweise ergibt sich die gesamte basale Insulinabgabe. Es gibt aber auch andere Vorgehensweisen. So wird bei der Tandem t-slim X2 CONTROL IQ die einprogrammierte Basalrate hoch- bzw. heruntergeregelt. Weil in die Pumpe insgesamt 6 individuelle Basalratenprofile programmiert werden können, z.B. auch für Sport, Schichtarbeit etc., kann auf die jeweiligs günstige Basalrate zurückgegriffen werden. Das erleichtert dem Algorithmus die Arbeit (Abb D1T 9).
Bolusabgabe weiterhin manuell notwendig
Allerdings muss sich der AID-Nutzer den zur Abdeckung einer Mahlzeit notwendigen Bolus weiterhin manuell dosieren. Dazu werden die gegessenen Kohlenhydrate eingestellt. Die Insulinmenge pro BE bzw. KHE ist im System hinterlegt. Bei einigen Systemen wird die Größe der Mahlzeit nur noch qualitativ angegeben. Das System rechnet sich den Bolus anhand seiner „Erfahrungen“ aus. Diese Vorgehensweise vermeidet eine exakte Schätzung der Kohlenhydrate. Beides, die automatische Gabe der basalen Insulindosis und die manuelle Gabe der Boli machen das Hybrid-AID-System aus. Weitere Entwicklungen werden dafür sorgen, dass demnächst auch die Mahlzeitenboli automatisch abgegeben werden, so dass ein Voll-AID-System entsteht. Auf diesem Weg ist z.B. das System iLET der amerikanischen Firma Beta-Bionics weit fortgeschritten.Bei den Systemen der 1. Generation wurde ein Korrekturboli im Fall erhöhter Glukosewerte ebenfalls noch manuell abgerufen. Bei der 2. Generation von AID-Systemen werden dagegen auch die Korrekturboli automatisch abgegeben, weshalb von einem Advanced Hybrid AID gesprochen wird (AH-AID).
Sicherheitsmodus bei AID-Systemen
Zum Algorithmus gehören auch Sicherheitsmodi, wenn das System im automatischen Modus betrieben wird. Diese gewährleisten die Anwendungssicherheit des AID und verhindern, dass bei nicht ganz klaren Stoffwechselsituationen oder bei fehlenden Glukosedaten das System sofort aus dem automatischen Modus aussteigt. Im Detail sind diese Sicherheitsaspekte bei allen Systemen unterschiedlich, auch wenn sie das gleiche bewirken.Details finden sich zum Beispiel in den „AID-Steckbriefen“ der Arbeitsgemeinschaft Diabetes-Technologie (AGDT) (Steckbriefe für Systeme zur Automatisierten Insulin-Dosierung (AID) – AGDT). Es wird empfohlen, diese in der Diabetespraxis bereit zu legen.
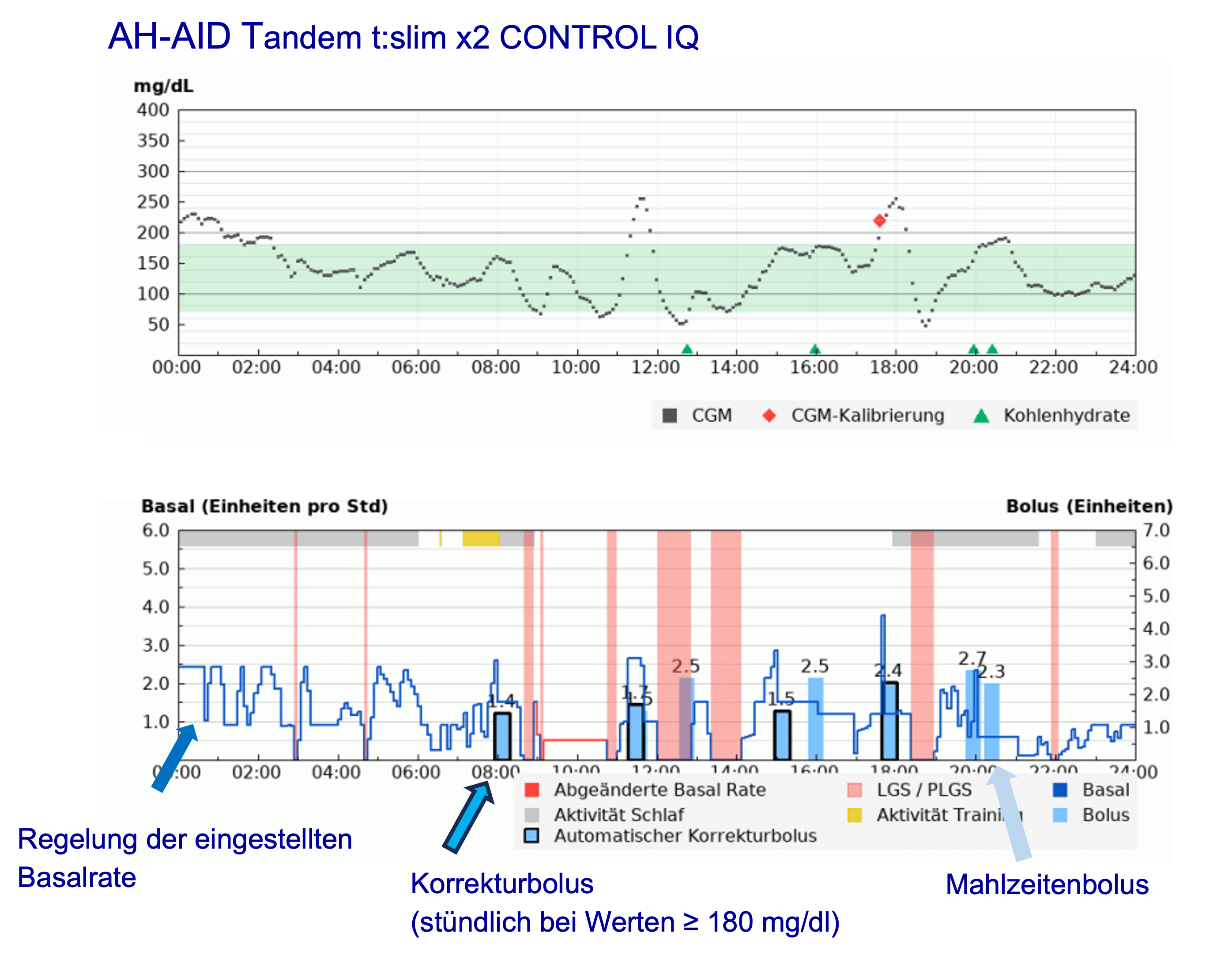
Abb. T1D 9: Arbeitsweise verschiedener Algorithmen
Ergebnisse von Studien zur Insulinpumpentherapie mit AID
Bereits die ersten Studien mit einem Hybrid-AID-System zeigten, dass Menschen mit Typ-1-Diabetes HbA1c-Werte um die 7% und darunter erreichten, wobei der Anteil der Werte im Zielbereich von 70-180 mg/dl (3,9-10 mmol/l) – der sogenannten Time in Range (TIR) – durchschnittlich höher als 70% lag [4]. Dies wurde erreicht, ohne dass schwere Hypoglykämien auftraten.Ein weiteres, sehr wesentliches Ergebnis ist, dass vergleichbare Daten nicht nur in den Studien mit ganz verschiedenen AID-Systemen auftreten, sondern dass sich diese auch in großen Kohorten von Menschen mit Typ-1-Diabetes unter Alltagsbedingungen bestätigen (Real-World-Analysen). Stellvertretend für viele Erhebungen ergab z.B. eine Auswertung von 119.274 Patienten in den USA und 4.690 in Europa eine TIR von ca. 72% und einen HbA1c von knapp unter 7% [5].
Weiterentwicklung: Advanced Hybrid-Automated-Systeme (AH)
Bei Nutzung von Advanced Hybrid-Automated (AH)-AID-Systemen sind die erreichten Ergebnisse sogar noch etwas besser, bedingt durch die automatische Gabe der Korrekturboli. Es zeigt sich, dass die Anwendung von AID-Systemen zu einer Glykämie führt, die von anderen großen Patientenkohorten mit anderen therapeutischen Optionen keinesfalls erreicht wird. Das hat zur Folge, dass sowohl akute Komplikationen (schwere Hypoglykämien, diabetische Ketoazidosen), als auch diabetische Folgeerkrankungen in den Hintergrund treten. Das betrifft natürlich nur Menschen mit Typ-1- Diabetes, die bereits frühzeitig in ihrer Diabeteshistorie eine solche Technologie anwenden konnten. Ganz wesentlich ist, dass diese Ergebnisse seitens der Anwender ohne besonders hohen Aufwand beim Therapiemanagement erreicht werden.Insgesamt ist die Beweislage für die erfolgreiche Anwendung der Insulinpumpentherapie mit AID ausgesprochen gut und zeigt sich in ca. 1.100 publizierten Studien [6]. Beispielhaft dazu eine Metaanalyse [7]. In den verschiedenen Datenbanken wurde 28 randomisierten kontrollierte Studien zur Anwendung aller bekannten AID-Systeme gesucht. Die Ergebnisse wurden mit anderen Arten der subkutanen Insulintherapie unter Verwendung von CGM verglichen. Im Ergebnis zeigten alle relevanten Studien, dass bei Menschen mit Typ-1-Diabetes bei Anwendung eines AID eine verbesserte glykämische Kontrolle auftritt, mit weniger Hypoglykämien, einer geringeren Krankheitslast und einer erhöhten Zufriedenheit (Abb. T1D 10).
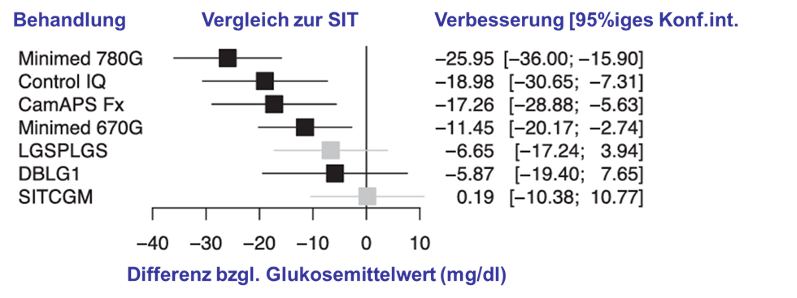
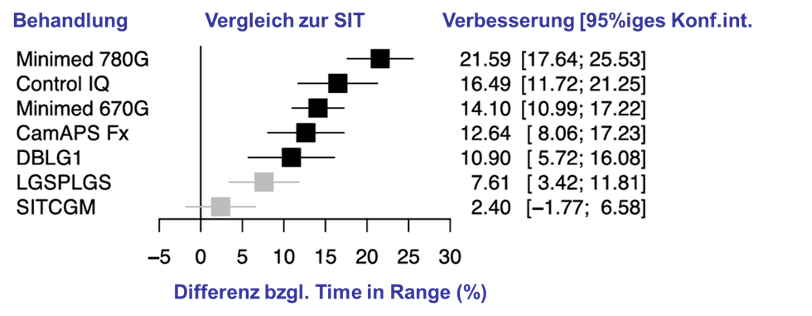
Abb. T1D 10: Ergebnisse einer Metaanalyse von 28 randomisierten kontrollierten Studien. Die AID-Systeme verbessern den Mittelwert der Glukose bis zu mehr als 25 mg/dl und erhöhten die TIR um bis zu mehr als 21% [27].
Wie finde ich die richtige Insulinpumpe bzw. das richtige System?
Nachdem die Entscheidung für eine Insulinpumpentherapie gefällt wurde, stellt sich die Frage, mit welcher Insulinpumpe die Behandlung durchgeführt werden sollte. Relativ klar dürfte in der Regel die Entscheidung für ein AID-System ausfallen. Dass Menschen mit Diabetes die Insulinpumpentherapie ohne AID durchführen wollen, ist inzwischen eher selten.Das erste Entscheidungskriterium ist folglich:
- Soll ein AID-System genutzt werden oder nicht?
- Falls bereits ein CGM genutzt wird: Soll die Insulinpumpe mit diesem CGM-System kompatibel sein? Prinzipiell ist die Leistungsfähigkeit bzgl. der Stoffwechseleinstellung der verschiedenen AID-Systeme ähnlich. Sie zeigten allesamt positive Ergebnisse in den klinischen Studien.
- Soll es eine schlauchgebundene Pumpe oder eine Patch-Pumpe sein (unter der wichtigen Bedingung, ob sie als AID funktionieren soll oder nicht)?
Die meisten Insulinpumpen verwenden ein Infusionsset, das die Pumpe über einen Schlauch mit dem Körper verbindet. Es gibt auch Insulin-Patch-Pumpen, bei denen Insulinpumpe und Infusionsnadel eine Einheit bilden – der Schlauch entfällt. Diese Pumpe wird auf die Haut geklebt und über ein externes Steuergerät bedient. - Wie sind Größe, Gewicht, Design, Farbe?
- Wie ist der Tragekomfort einzuschätzen? Das schließt die Betrachtung der verfügbaren Pumpentaschen, Clips usw. mit ein.
- Erscheint die Bedienung einfach?
- Im Fall, dass ein Kind das AID-System nutzen soll: ist dieses für das Alter des Kindes zugelassen (es gibt Systeme, die nur für Erwachsene zugelassen sind)?
- Wird der minimal notwendige Tagesinsulinbedarf für die sichere Funktion des Systems erreicht?
- Wie groß ist der eigenen Insulinbedarf? Passt eine Insulinpumpe mit der entsprechenden Ampullengröße dazu?
Die kleinste Ampulle fasst 160 IE Insulin, die größte 300 Einheiten (Ampullen mit 315 IE Insulin werden in Pumpen eingesetzt, die nicht mehr erhältlich, aber von einigen Patienten noch genutzt werden). Ist der tägliche Insulinbedarf hoch, sollte eine Insulinpumpe mit einem großen Fassungsvermögen der Ampulle gewählt werden. Zu beachten ist z.B. bei der Patchpumpe Omnipod, dass der Pod alle 3 Tage gewechselt werden muss. Das ist mit seinem Fassungsinhalt (maximal 200 IE) in Übereinstimmung zu bringen. - Sollen die Therapiedaten auf dem persönlichen Smartphone angezeigt werden?
AID-Systeme lassen sich nicht nur im automatischen Modus nutzen, sondern auch manuell mit und ohne CGM-Anbindung, womit manuelle Einstellungen wichtig werden. Es kann auch sein, dass die „klassische“ CSII damit ausgeführt wird. Technische Kriterien sind dann: - Wie viele Basalraten-Profile werden benötigt bzw. gewünscht?
Hier liegt die Spanne zwischen 2 und 8 programmieren Basalratenprofilen. Personen mit stark wechselnden Unterschieden im Tagesverlauf und körperlicher Aktivität benötigen mehrere Basalraten-Profile, um schnell wechseln können. Insbesondere Personen mit hoher Insulinsensitivität haben einen stark, wechselnden Insulinbedarf und es sollten viele Basalraten programmierbar sein. - Temporäre Basalraten-Senkung/Erhöhung. Um flexibel in der Lebensgestaltung zu sein, sollte die Insulinpumpe über eine temporäre Basalratenabsenkung bzw. -erhöhung verfügen. In Phasen körperliche Aktivität kann die Basalrate in Prozentschritten für einen bestimmten Zeitraum abgesenkt werden. Umgekehrt kann in Phasen der Ruhe eine höhere Basalrate notwendig sein. Die Insulinpumpen haben daher die Möglichkeit die Basalrate für einen bestimmten Zeitraum von 0% bis ungefähr 200 % zu senken oder zu erhöhen.
Literatur:
[1] Biester T, Kordonouri O, Holder M, et.al. “Let the Algorithm Do the Work”: Reduction of Hypoglycemia Using Sensor-Augmented Pump Therapy with Predictive Insulin Suspension (SmartGuard) in Pediatric Type 1 Diabetes Patients. Diabetes Technol Ther. 2017 Mar;19(3):173-182.
[2] Thomas A, Heinemann L. Algorithms for Automated Insulin Delivery: An Overview. J Diabetes Sci Technol. 2022;16(5):1228-1238.
[3] Thomas A. AID: So wird die Insulinabgabe berechnet. Diabetes-Forum 5/2021: 10-15.
[4] Bergenstal RM, Garg S, Weinzimer SA, et.al.. Safety of a hybrid closed-loop insulin delivery system in patients with type 1 diabetes. JAMA 2016;316:1407-1408.
[5] Agrawal P, Stone M, Gopalakrishnan S et.al. Real-World Data from the MiniMed™ 670G System Commercial Launch. ADA 2018, Orlando, Diabetes 2018; 7(Suppl.1): A249-A250.
[6] Datenbank Pubmed, Stichwort “automated insulin delivery”. Letzter Aufruf: 03.06.2025.
[7] Di Molfetta S, Di Gioia L, Caruso I, et.al. Efficacy and Safety of Different Hybrid Closed Loop Systems for Automated Insulin Delivery in People With Type 1 Diabetes: A Systematic Review and Network Meta-Analysis. Diabetes Metab Res Rev. 2024; 40(6):e3842.
Kategorisiert in: Therapie Typ 1
Dieser Artikel wurde verfasst von admin










