Die kontinuierliche Glukosemessung (rtCGM)
Bedeutung der kontinuierlichen Glukosemessung (rtCGM)
Die kontinuierliche Glukosemessung (rtCGM) entwickelte sich in den letzten 15 Jahren zu einem Eckpfeiler des Diabetesmanagements. Anfang 2025 tragen weltweit ca. 10 Millionen Patienten ein CGM [1]. Der Gesamtumsatz betrug 2024 ca. 10 Milliarden $US und ist stark steigend (zum Vergleich: SMBG ca. 1,7. Milliarden $US, fortwährend leicht fallend) [1]. Die CGM-Systeme können dabei entweder als sogenannte „Stand-alone“-Geräte genutzt werden, z. B. bei Patienten mit ICT („Sensorunterstützte Therapie“; SuT), oder in Kombination mit einer Insulinpumpe, sowohl ohne automatisierte Insulinabgabe (mit oder auch ohne Hypoglykämieabschaltung; „Sensorunterstützte Pumpentherapie“; SuP) oder mit automatisierter Insulinabgabe (AID-System; Automatisierte Insulin Dosierung). Mittlerweile sind mehrere AID-Systeme unterschiedlicher Hersteller auf dem Markt verfügbar, bei denen neben der basalen Insulinabgabe auch die Korrekturboli im Fall erhöhter Glukosewerte automatisch abgegeben werden (Advanced Hybrid AID-Systeme).Erweiterte Möglichkeiten: Einsatz in der Diabetestherapie
Der ständige Fortschritt bei der Messgenauigkeit, der Handhabung und des Tragekomforts der CGM-Systeme hat das Feld der Anwendungen stark erweitert bis hin zum Einsatz in automatisierten Insulinabgabesystemen (AID-Systeme). Abb. SK 8 zeigt diese Anwendungsbreite. Die rtCGM-Systeme ermöglichen:1. zumindest weitgehend die Substitution der Blutglukosemessung, insofern die Glukosesensoren werkseitig kalibriert worden sind. Zwar muss der Glukosesensor nach 7-14 Tagen neu gesetzt werden, doch das ist für die Patienten weniger belastend als 4-7 -mal täglich eine Selbstverletzung zur Blutentnahme für die SMBG durchführen zu müssen (allerdings sollte das rtCGM bei unklaren Glukoseverläufen mit einer Blutglukosemessung überprüft werden). Das heißt, werkskalibrierte CGM-Sensoren erfüllen näherungsweise den Wunsch der Patienten, sich möglichst „nicht mehr stechen zu müssen“.
2. den Patienten ein „Biofeetback“, d.h. sie können die Auswirkungen von Mahlzeiten und körperlicher Aktivität unmittelbar einsehen und daraus Schlussfolgerungen für ihr Therapiemanagement ziehen.
3. eine optimale Therapieunterstützung besonders von insulinbehandelten Patienten (Sensorunterstützte Therapie (ICT plus CGM); Sensorunterstützte Pumpentherapie (CSII plus CGM)), aber auch darüber hinaus.
4. die Anbindung an Insulinpumpen und ist damit gerätetechnisch ein wesentlicher Teil und eine grundlegende Voraussetzung von AID-Systemen (AID – automated insulin delivery; automatische Insulindosierung).
5. eine grundlegend neue Sicht auf die Regulierung des Glukosestoffwechsel und dessen Beurteilung.
6. unter der Voraussetzung vorliegender Interoperabilität die Kopplung von verschiedenen Geräten (Smart-Pens, AID-Systemen) und Softwarelösungen.
7. den Einsatz im Rahmen der Digitalisierung (Übergabe und Analyse der Daten in Datenmanagement-Systemen, Digitalen Gesundheitsanwendungen (DiGA), Patienten- und Therapieentscheidungs-Hilfssystemen).
Daraus ergibt sich auch eine Erweiterung der Indikationen für das rtCGM. In Deutschland ist nach dem Beschluss des Gemeinsamen Bundesausschusses (GBA) vom 16. Juni 2016 die Verordnung von rtCGM an alle Patienten mit intensivierter Insulintherapie (ICT) und Insulinpumpen möglich [2].
Bedingt durch die Erfahrungen beim Einsatz von rtCGM ist dessen Vorteil auch gegeben bei Patienten mit erhöhtem kardiovaskulärem Risiko. CGM kann rechtzeitig unphysiologische und rasche Glukoseexkursionen sichtbar machen. Weiterhin ist dessen intermittierender Einsatz in der Phase des Prädiabetes bzw. in einer frühen Diabetesphase sinnvoll, um ggf. durch Lebensstiländerung eine Remission des Typ-2-Diabetes zu erreichen oder die volle Ausprägung dieses Krankheitsbildes zu verhindern („Biofeetback“).
Auch der intermittierende Einsatz zu Schulungszwecken ist sinnvoll, um dem Diabetespatienten die Auswirkungen von Mahlzeiten und Bewegung auf den Glukoseverlauf zu zeigen und somit zu einer Lebensstiländerung zu motivieren [3]. Das setzt aber die Zusammenarbeit bzw. die Unterstützung des Patienten durch das Diabetesteam voraus. Generell ist CGM zu einem zentralen Werkzeug für die Weiterentwicklung des Diabetesmanagements geworden.

Abb. SK 8: Beeinflussung der Diabetestherapie, des Diabetesmanagements und der Beurteilung der Glukosedaten durch rtCGM.
Was leistet ein System zur kontinuierlichen Glukosemessung (CGM)?
Obwohl es sich bei CGM zunächst nur um eine Messmethode handelt, revolutionierte diese das Diabetesmanagement und die Diabetestherapie in einem hohen Maße. Eine entscheidende Voraussetzung dazu war die Gewährleistung einer ausreichenden Messgenauigkeit. Am Anfang stand allerdings im Vordergrund, detaillierte Einblicke in die Glukoseregulation zu erhalten. Dies war unter der punktuellen Blutzuckermessung (SMBG) nur bedingt möglich, denn selbst 7 und mehr Blutglukosemessungen am Tag konnten kein vollständiges Bild ergeben.Ebenfalls im sofortigen Interesse stand die Beurteilung der Stoffwechseleinstellung, vor allem aber die Vermeidung von Hypoglykämien. Unter der punktuellen Blutzuckermessung kann man diese nur bedingt richtig beurteilen. Falls der Patient nicht zufällig tiefe Glukosewerte misst, setzt der Nachweis einer Hypoglykämie voraus, dass er diese bemerkt, die Hypoglykämie also symptomatisch ist. Ob er mit der punktuellen Blutzuckerselbstkontrolle den tiefsten Wert ermittelt, ist dabei nicht sicher. Auch die Dauer und damit die Intensität der Hypoglykämie ist mit der punktuellen Messung schwer zu beurteilen.
Durch CGM ist das aber absolut möglich, denn anhand des Glukoseverlaufs sind die Tiefe und die Dauer der Hypoglykämie sichtbar. Außerdem kann der Einsatz von CGM helfen, Hypoglykämien zu verhindern. Neben der auf dem Display sichtbaren Entwicklung der Komplikation kann mit Hilfe von Voralarmen (Warnmeldungen) vor einer sich abzeichnenden Hypoglykämie gewarnt werden. Zusätzlich helfen Alarme mit anderen Alarmtönen, auf diese aufmerksam zu machen. Folgerichtig wurde in der Vermeidung von Hypoglykämien ein wesentliches Einsatzfeld von rtCGM gesehen. Zahlreiche Studien belegen den Erfolg davon (HypoDE-Studie [4], IN-CONTROL Studie [5], GOLD-Studie [6] usw.).
Diese Daten stellt ein System zur kontinuierlichen Glukosemessung (CGM) bereit
CGM liefert eine Reihe von Glukosedaten, die eine umfassendere Beurteilung der Glukoseregulation zulassen, als durch die punktuelle Blutglukosemessung und den Langzeitglukosewert HbA1c allein. Letzterer ist zwar nach wie vor ein Goldstandard, um den Erfolg einer Therapie zu beurteilen, hat aber gewisse Nachteile: Nur Beurteilung der mittleren Glukose über einen Zeitraum von 2-3 Monaten; Glukoseschwankungen sind nicht nachweisbar; es existieren eine Reihe von Einflüssen (z.B. Erkrankungen, verschiedene Medikamente). Die durch CGM erzeugten Daten erweitern somit wesentlich die Möglichkeiten der Therapiebeurteilung und -optimierung.Zu den Daten aus CGM-Profilen gehören:
- der die Gesamtheit aller Glukosewerte berücksichtigende Mittelwert der Glukosekonzentration und dessen Standardabweichung
- die Beurteilung von Glukoseschwankungen anhand des Variationskoeffizienten (man teilt die Standardabweichung durch den Mittelwert der Glukosekonzentration und nimmt das mal 100%)
-
die verbrachte Zeit pro Tag in definierten Glukosebereichen:
– Zeit im Zielbereich (TiR: „Time in Range“): 70-180 mg/dl (3,9-10,0 mmol/l)
– Zeit im Glukosebereich („Time below Range“; TBR) < 70 mg/dl (3,9 mmol/l)
– Zeit im Glukosebereich („Time above Range“; TAR) > 180 mg/dl (10,0 mmol/l) - die Anzahl an Glukoseauslenkungen/Tag in den Glukosebereich < 70 mg/dl (3,9 mmol/l) (Rate an Hypoglykämien)
- die Anzahl an Glukoseauslenkungen/Tag in den Glukosebereich > 180 mg/dl (10,0 mmol/l) (Rate an Hyperglykämien). Diese Parameter sind direkt den CGM-Kurven zu entnehmen, die entstehen, wenn das CGM mit einer entsprechenden Software ausgelesen wird.
Als einer der wichtigsten, hier aufgeführten Parameter hat sich der Anteil der Zeit im Glukosezielbereich von 70-180 mg/dl (3,9-10,0 mmol/l), die sogenannte „Time in Range“ etabliert [7]. Diese zeigt neben dem HbA1c-Wert den Erfolg der durchgeführten Therapie. Dazu leitete eine internationale Expertengruppe Empfehlungen für eine optimale Diabeteseinstellung ab, der eine Vielzahl von Studien für verschiedene Patientengruppen zugrunde liegen. Diese Richtwerte sind in Tabelle. SK 1 zusammengefasst.
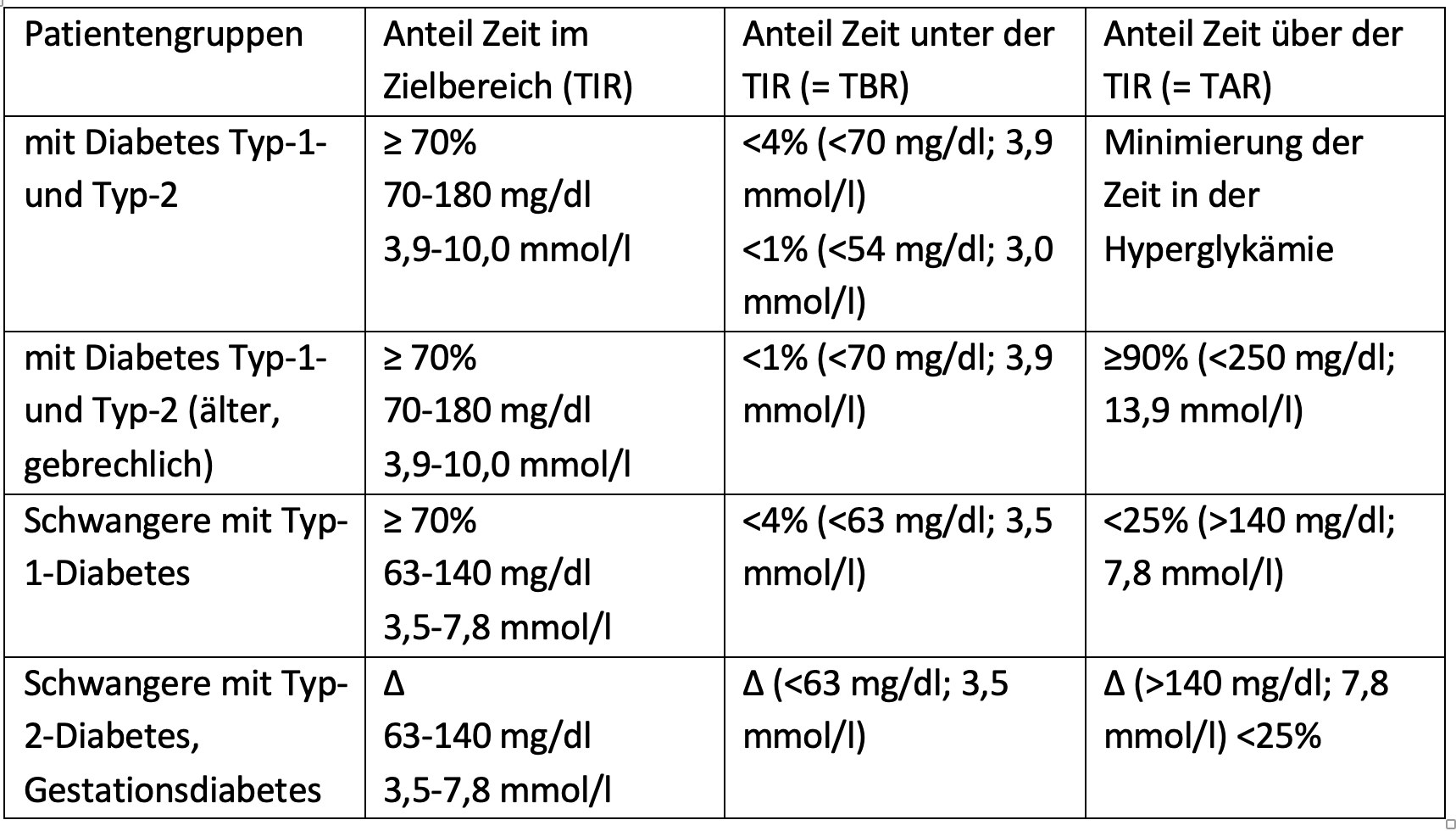 Tabelle SK 1: Richtwerte anhand von CGM-Daten für verschiedene Gruppen von Menschen mit Diabetes nach den Empfehlungen einer internationalen Expertengruppe [7] (∆ – genaue Anteile der Zeit wurden nicht festgelegt; weitere Forschung ist nötig).
Tabelle SK 1: Richtwerte anhand von CGM-Daten für verschiedene Gruppen von Menschen mit Diabetes nach den Empfehlungen einer internationalen Expertengruppe [7] (∆ – genaue Anteile der Zeit wurden nicht festgelegt; weitere Forschung ist nötig).Auswertung der CGM-Daten:Software und Ambulantes Glukoseprofil (AGP)
CGM liefert bei konsequenter Nutzung fortlaufend einen nahezu lückenlosen Verlauf von Glukosedaten (288-1440 Werte/Tag je nach System) und damit eine detaillierte Betrachtung der glykämischen Regulation. Das ermöglicht sowohl die Therapieunterstützung (SuT und SuP) als auch die Therapiesteuerung (AID).Auch wenn im Fall automatisierter Therapiesysteme die CGM-Glukosewerte ohne Zutun der Patienten genutzt werden, ist die Verarbeitung und Analyse der anfallenden großen Datenmenge mit Hilfe einer Software essentiell. Für die Anwender steht dabei die schnelle Datenverfügbarkeit im Vordergrund, während es für das Behandlungsteam um die detaillierte Beurteilung des Therapieerfolges geht, ggf. als Basis für eine notwendige Therapieoptimierung. Das alles erfordert Softwarelösungen, sowohl als PC-Software bzw. Web-Browser-Anwendungen als auch als Applikation für Smartphones.
In der für jedes CGM-System verfügbaren Auswertesoftware werden die Glukoseprofile und alle wesentlichen Daten dargestellt (Daten, welche ein rtCGM bereitstellt). Allerdings ist es nicht immer einfach, aus den einzelnen, hintereinander dargestellten Tagesprofilen typische Details in der Glukoseregulation zu erkennen. In der Vergangenheit wurden die Verlaufsgraphen deshalb übereinander dargestellt, die sogenannten „Spagetti-Kurven“. Meist überlagerten sich damit 14 Kurven über 14 Tage, was die Übersicht erschwerte (Abb. SK 8, oben).
Deshalb wurde in einem internationalen Konsensus-Statements die Darstellung als ambulante Glukoseprofil (AGP) vorgeschlagen [7] (Abb. SK 9, unten). Aus den übereinander gelegten originären Glukosekurven werden der Median dargestellt und zwei Bereiche, der Interquartilsbereich (IQR), welcher alle Daten zwischen der 25.–75. Perzentile umfasst und der Interdezilbereich (IDR), begrenzt von der 10. und 90. Perzentile. Daraus lassen sich schnell einige Schlussfolgerungen ziehen. Sind die Bereiche IQR und IDR schmal, so liegt eine niedrige Tag-zu-Tag Variabilität vor. Wenn Teile des IDR-Bereiches die Hypoglykämieschwelle von 70 mg/dl (3,9 mmol/l) unterschreiten, so liegt eine erhöhte Hypoglykämiegefahr vor usw. Mit dem AGP ist es möglich, zu 90 % zuverlässige Aussagen zu Glukosemustern zu treffen [8]. Es generiert einen schnellen Überblick, der allerdings zunächst nur zur Kreierung einer Hypothese taugt. Durch ein schnelles Screenen der konsekutiven Tagesprofile lässt sich diese bestätigen oder verwerfen [9]. Zur Interpretation des AGP existiert mit der AGP-Fibel ein gut strukturiertes Buch [10].
Neben der Darstellung in Abb. SK 9 existiert auch eine AGP-Variante, in welcher die hellblauen (IDR) und dunkelblauen (IQR) Bereiche entsprechend der Höhe der Glukosewerte in den jeweiligen Glukosebereichen eingefärbt sind (Abb. SK10) : < 54 mg/dl (3,0 mmol/l) – dunkelrot, 54 - < 70 mg/dl (3,0 - < 3,9 mmol/l) –rot, 70 – 180 mg/dl (3,9 – 10,0 mmol/l – grün, > 180 – 250 mg/dl (> 10,0 – 13,9 mmol/l) – gelb und > 250 mg/dl (> 13,9 mmol/l) – orangefarben [11].
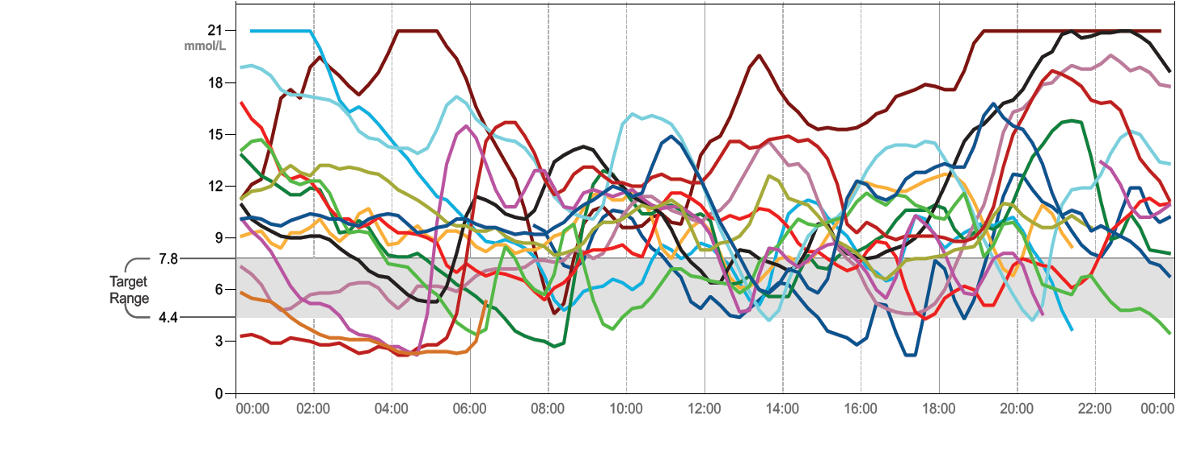
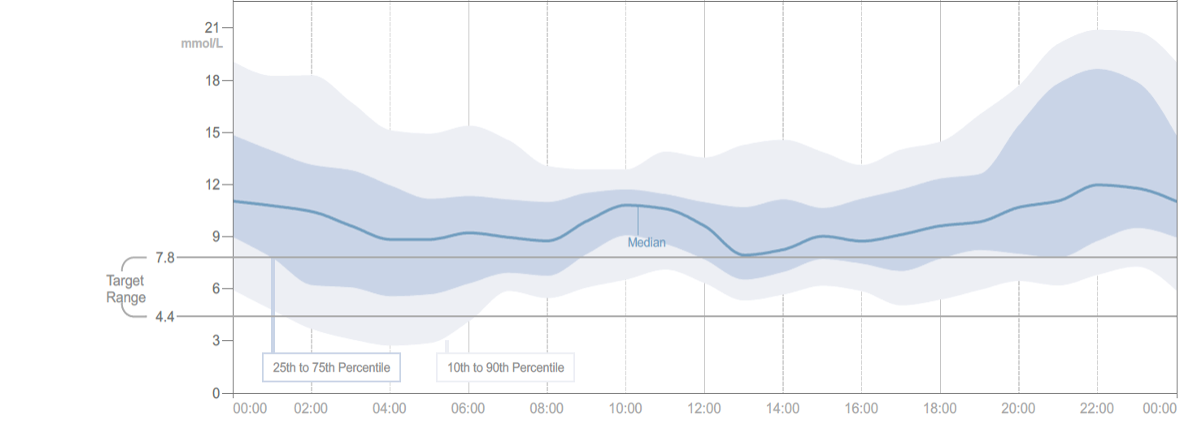
Abb.SK 9: Darstellung der originalen CGM-Kurven über 14 Tage (oben) und das sich daraus ergebende AGP (unten). Die AGP-Darstellung zeigt schematisch die Aufbereitung der obigen Kurven (dunkelblaue Linie: Median der Glukosewerte; dunkelblau: Interquartilsbereich (IQR), hellblau: Interdezilbereich (IDR)). Die roten Pfeile zeigen abfallende, der grüne Pfeil ansteigende Werte an verschiedenen Tagen, aber zur gleichen Tageszeit. Diese Tage nivellieren den Verlauf gegen 8:00 Uhr und lassen den Median im AGP in diesem Zeitabschnitt horizontal verlaufen. Dazu ist aber der IDR-Bereich verbreitert.
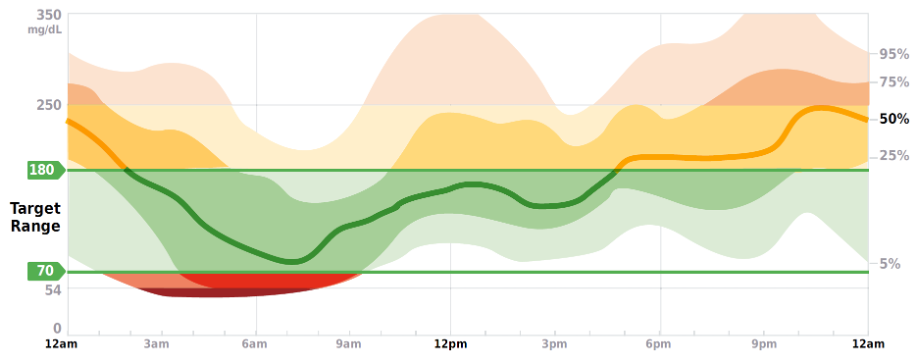
Abb.SK 10: Darstellung des AGP in unterschiedlichen Farben entsprechend der Höhe der Glukosebereiche [10].
Entwicklung von Systemen zur kontinuierlichen Glukosemessung (CGM)
Das erste CGM-System wurde 1999 in den Markt eingeführt (CGMS der Firma MiniMed). Zunächst handelte es sich dabei um ein verblindetes CGM-System, d.h. die Glukosedaten wurden erst nach Ablegen des Glukosesensors und dem Herunterladen der Daten in eine Software sichtbar. Damit diente verblindetes CGM ausschließlich diagnostischen Zwecken.2004 wurde dann das erste System mit Anzeige der aktuellen Glukosewerte (Guardian RT der Firma MiniMed) für die Patienten verfügbar (es gab 2002 mit dem GlucoWatch Biographer der Firma Cygnus schon einmal ein CGM mit Anzeige der Glukosewerte, welches sich aber im Markt nicht durchsetzen konnte). CGM-Systeme mit aktuell sichtbaren Glukosewerten werden als Real-Time CGM (rtCGM) bezeichnet. Damit wurde ein Wunsch der Patienten wahr, den Glukoseverlauf fortlaufend gemessen zu bekommen und dabei neben dem Glukosewert auch den Glukosetrend beobachten zu können.
Seit Herbst des Jahres 2016 werden die Kosten für CGM-Systeme bei entsprechender Indikation auch von den Krankenkassen in Deutschland übernommen. [11].
Literatur:
[1] Kelly Close Report 21.01.2025
[2] Bundesministerium für Gesundheit: Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden vertragsärztliche Versorgung: Kontinuierliche interstitielle Glukosemessung mit Real-Time-Messgeräten (rtCGM) zur Therapiesteuerung bei Patientinnen und Patienten mit insulinpflichtigem Diabetes mellitus vom 16. Juni 2016. Bundesanzeiger, herausgegeben vom Bundesministerium der Justiz und für Verbraucherschutz, vom 6. September 2016. https://www.g-ba.de/downloads/39-261-2623/2016-06-16_MVV-RL_rtCGM_BAnz.pdf?msclkid=ddce3b8ad03111ec9258e12d62f0496e. Letzter Zugriff: 17.03.2025.
[3] Thomas A, Haak T, Tombek A, Kulzer B, Ehrmann D, Kordonouri O, Kroeger J, Schubert-Olesen O, Kolassa R, Siegmund T, Haller N, Heinemann Lutz. Expertenaustausch zum Einsatz von kontinuierlichem Glukosemonitoring (CGM) im Diabetesmanagement: Eine aktuelle Bestandsaufnahme und Blick in die Zukunft. Diabetologie und Stoffwechsel 2023; 18(01): 57 – 68. [4] Heinemann L, Freckmann G, Ehrmann D, Faber-Heinemann G, Guerra S, Waldenmaier D, Hermanns N. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial. Lancet 2018;391:1367–1377.
[5] van Beers CA, DeVries JH, Kleijer SJ, et al. Continuous glucose monitoring for patients with type 1 diabetes and impaired awareness of hypoglycaemia (IN CONTROL): a randomised, open-label, crossover trial. Lancet Diabetes Endocrinol 2016;4:893-902.
[6] Lind M, Polonsky W, Hirsch IB, Heise T, Bolinder J, Dahlqvist S, Schwarz E, Ólafsdóttir AF, Frid A, Wedel H, Ahlén E, Nyström T, Hellman J. Continuous Glucose Monitoring vs Conventional Therapy for Glycemic Control in Adults With Type 1 Diabetes Treated With Multiple Daily Insulin Injections: The GOLD Randomized Clinical Trial. JAMA. 2017 Jan 24;317(4):379-387
[7] Battelino T, Danne T, Bergenstal RM, et.al. Klinische Zielwerte für die Interpretation von Daten des kontinuierlichen Glukosemonitorings: Empfehlungen zur Time in Range (Zeit im Zielbereich) der internationalen Konsensusgruppe. Diabetes Care. 2019;42(8):1593-1603.
[8] Dunn TC, Crouther N. Assessment of the variance of the ambulatory glucose profile over 3 to 20 days of continuous glucose monitoring. Diabetologia 2010;53 (Suppl. 1):S421. [9] Kröger J, Reichel A, Siegmund T, Ziegler R. Clinical Recommendations for the Use of the Ambulatory Glucose Profile in Diabetes Care. J Diabetes Sci Technol. 2020 May;14(3):586-594. doi: 10.1177/1932296819883032.
[10] Kröger J, Reichel A, Siegmund T, Ziegler R. Das Ambulante Glukoseprofil strukturiert auswerten. Kirchheim-Verlag 2018. ISBN 978-3-87409-670-6
[11] Holt RIG, DeVries JH, Hess-Fischl A, Hirsch IB, Kirkman MS, Klupa T, Ludwig B, Nørgaard K, Pettus J, Renard E, Skyler JS, Snoek FJ, Weinstock RS, Peters AL. The management of type 1 diabetes in adults. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia[24]. 2021 Dec;64(12):2609-2652.
Kategorisiert in: Selbstkontrolle
Dieser Artikel wurde verfasst von admin